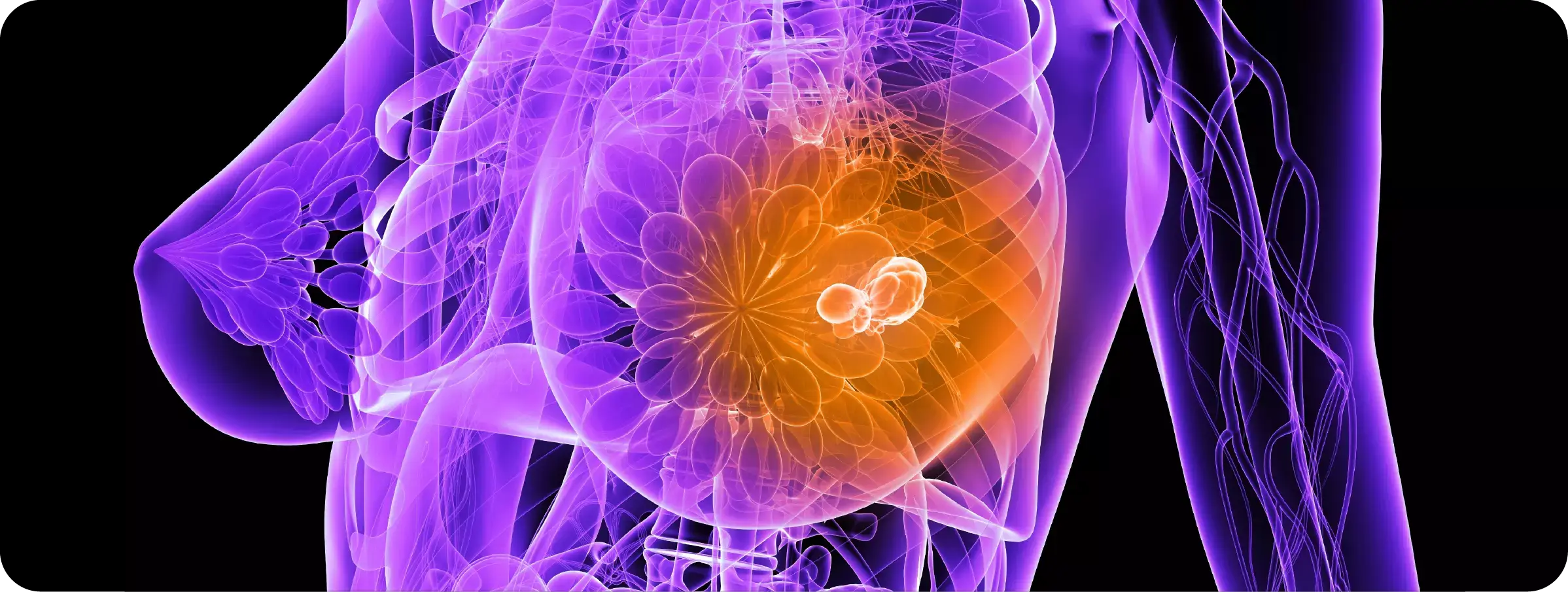
EL CÁNCER DE SENO: UN DESAFÍO HISTÓRICO PARA LA CIENCIA
Por iniciativa de la Organización Mundial de la Salud el 19 de octubre se celebra mundialmente el Día Internacional de lucha contra el Cáncer de Mama con el objetivo de crear conciencia y promover que cada vez más mujeres accedan a controles, diagnósticos y tratamientos oportunos y efectivos. La detección precoz a fin de mejorar el pronóstico y la supervivencia de los casos de cáncer de mama sigue siendo la piedra angular de la lucha contra este cáncer. Los avances terapéuticos para el cáncer de mama han sido impulsados por numerosos agentes: centros de investigación privados, públicos, universidades e industrias farmacéuticas, programas de pacientes, hospitales, entre otros. Cada avance científico y tecnológico mejora el pronóstico de las y los pacientes afectados, mejora su expectativa de vida y construye un futuro que antes fue inimaginable.

Al hablar de la historia del cáncer de mama es necesario remontarnos a la antigua civilización egipcia, quienes documentaron por primera vez el caso y el procedimiento contra tumores en la mama en el papiro ahora nombrado Edwin Smith Surgical Papyrus que data del 3000 al 2500 a. C. Más de 2000 años después Hipócrates formuló su teoría de los cuatro humores, en la cual postuló que los seres vivos están formados por sangre, bilis amarilla, bilis negra y flema, y aseguró que la salud dependía del equilibrio de estos cuatro componentes y describió las etapas progresivas del cáncer de mama. 1

En el año 200 d.C., el médico griego Claudio Galeno hizo una descripción detallada de los tumores mamarios y los definió como crecimientos anormales de la mama, los cuales era más común encontrarlos en mujeres que en hombres, sobre todo en aquellas cuyo ciclo menstrual fuera anormal o nulo; además, concluyó que el cáncer no era específico de la mama, sino que podría aparecer en cualquier parte del cuerpo. Durante el primer siglo, los médicos romanos trataban los tumores extrayendo el músculo pectoral en su totalidad. Posteriormente, Galeno propuso un tipo de lumpectomía en la cual se realizaba una incisión alrededor del tumor y se retiraba solamente el área afectada.2
Durante el siglo XVI en Europa, René Descartes, propuso la teoría de la linfa, la cual postulaba que, de todos los fluidos, la sangre y la linfa son los más importantes. Más tarde Stahl y Hoffman propusieron que el cáncer se componía de linfa fermentada y degenerada en su acidez o alcalinidad.3
Mientras tanto, el médico Bernardino Ramazzini notó una alta frecuencia de cáncer de mama en monjas italianas al compararlas con mujeres casadas y la atribuyó, como factor causal, al celibato, el cual, creía Ramazzini, ocasionaba la inestabilidad de los órganos reproductivos.4
Décadas después Claude Deshais-Gendron describió los tumores cancerígenos como una masa fría formada por glándulas y nervios endurecidos, la cual se fijaba y crecía en los tejidos circundantes. 5
Durante el siglo XVIII, John Hunter sugirió que el cáncer de mama se originaba debido a la coagulación defectuosa en los vasos linfáticos; además, propuso una nueva cirugía en la cual se debía extraer el tumor junto con la diseminación linfática. En el mismo siglo, Henri Le Dran postuló el cáncer como una enfermedad local que avanza en estadios y no de manera sistémica, como hasta entonces se creía, adicionalmente, propuso que el tumor mamario debería ser removido antes de su propagación hacia los nódulos linfáticos axilares. 6
Al adentrarse el siglo XIX, nuevas hipótesis sobre el origen de las células cancerosas fueron surgiendo. En 1838, Johannes Müller teorizó que las células cancerígenas provenían del crecimiento de células no diferenciadas y no del sistema linfático, como se creía hasta ese momento. 7
Robert Hooke quien introdujo el término célula, ocasionó que varios científicos se enfocaran en su estudio. Fue así como el médico alemán Rudolf Ludwig Karl Virchow dictaminó que todas las células provenían de otras células. En 1858, publicó que las células axilares metastásicas se originaban como respuesta a ingredientes dañinos o materia venenosa emitida por el cáncer en la mama.

Fue el año de 1882 el que marcó el rumbo en el tratamiento del cáncer de mama, con la introducción de la mastectomía radical por el cirujano William Halsted, ya que en su llamada teoría Virchow-Halsted postuló al cáncer como una enfermedad local, la cual hace metástasis a otros sitios a medida que progresa. En 1894 Halsted publicó los resultados de las cirugías con las que fueron tratadas 50 pacientes con cáncer de mama, con lo que concluyó que solo tres pacientes tuvieron recurrencia local, resultados excelentes al compararlos con los obtenidos por otros médicos, quienes reportaron recurrencias de más de 60% en las pacientes tratadas con las técnicas convencionales. 8
En 1896, The British Gynacological Society llevó a cabo, su reunión anual, en la que discutieron y expusieron los nuevos conocimientos obtenidos por medio de la clínica. Fue ahí donde el médico inglés George Thomas Beatson (1848-1933) declaró que tras realizar ooforectomía (extirpación de los ovarios) a pacientes con tumores mamarios, observó una ligera disminución del tamaño de los tumores, con lo que concluyó que la secreción interna de los ovarios estaba implicada en el desarrollo del tumor mamario. Por esa razón, es considerado el padre de la terapia antihormonal. 9
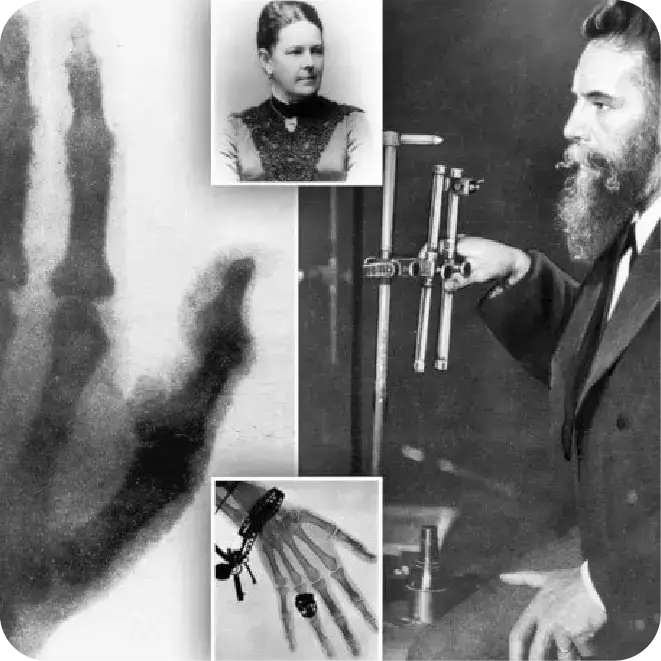
Durante ese mismo año en Alemania, Wilhelm Conrad Röntgen descubrió los rayos X. Gracias a este descubrimiento, Albert Salomon publicó en 1913 sus resultados de 3000 mastectomías en las cuáles encontró microcalcificaciones en imágenes de rayos X tomadas de muestras de tumor. Con ello pudo describir las diferencias en imagen de un tejido sano y uno con cáncer. 10
Retomando los avances en la radiación con el descubrimiento de los rayos X, el cirujano inglés Geoffrey Keynes, pionero en cirugía de cáncer de mama, quien desaprobaba la mastectomía radical, sugirió una cirugía más limitada seguida por radioterapia.11
Durante la Segunda Guerra Mundial, la armada de Estados Unidos retomó las investigaciones sobre el gas mostaza iniciadas en 1919 debido a los efectos tóxicos que causó al personal naval que había estado expuesto a ese gas. En este estudio se evaluó el nitrógeno de mostaza y se descubrió su toxicidad. Esto marcó el inicio de la investigación de agentes químicos capaces de matar células cancerígenas en crecimiento al dañar su ADN. 3
En 1956, después de años de investigación en el área de quimioterapia, el primer caso de cáncer metastásico fue curado al utilizar un compuesto llamado metotrexato. Este suceso marcó la historia del uso de la quimioterapia en el tratamiento del cáncer. 3
En la década de los sesenta Elwood Vernon Jensen describió el receptor de estrógenos y subsecuentemente descubrió la superfamilia de receptores nucleares de hormonas. 12 Mientras tanto, el mercado de anticonceptivos ya estaba establecido y los intentos de sintetizar compuestos no esteroideos antiestrógenos como anticonceptivos llevó a que el grupo de investigación de ICI Pharmaceuticals, ahora AstraZeneca, identificara el compuesto químico ICI 46,474, un isómero trans de trifeniletileno llamado tamoxifeno. Al hacer las pruebas del tamoxifeno en ratones, este se comportaba como un estrógeno; sin embargo, en ratas no se veía el mismo efecto, hecho que ocasionó incertidumbre acerca de su efecto sobre los humanos. Es por ello por lo que en 1972 se probó este compuesto en diversas aplicaciones que iban desde el tratamiento del cáncer de mama, hasta la inducción de la ovulación; sin embargo, tuvieron que pasar cinco años más para que la Food and Drug Administration (FDA) lo aprobara como tratamiento contra el cáncer de mama metastásico en los casos de tumores positivos a receptor de estrógeno (RE). 13
En 1974 fue descubierto el receptor para el factor de crecimiento epidermal (EGFR), el cual ha servido como blanco terapéutico contra el cáncer de mama por medio de inhibidores como el erlotinib, el gefitinib, el cetuximab y el afatinib.14 En 1985 Bernard Fisher, concibió en su hipótesis al cáncer como una enfermedad sistémica en la cual las células cancerosas podían viajar por el sistema circulatorio y linfático hacía otras zonas del cuerpo, por lo que propuso que esta enfermedad debía ser tratada con lumpectomía, acompañada con radioterapia y consideró que se obtendrían resultados iguales a la mastectomía radical. 15
Entre los trabajos realizados entre 1984 y 1986 por Alex Ullrich y en 1986 por Yakamoto fue descubierto el gen ERBB2, el cual fue mapeado en el cromosoma humano 17q21 .16
En 1987, Dennis Joseph Slamon demostró que el gen descubierto se encontraba amplificado en el cáncer de mama, sobre todo en aquellas mujeres con un pobre pronóstico.
El desarrollo de medicamentos contra el cáncer de mama comenzó su apogeo con Axel Ullrich. En 1989 descubrió que dirigir un anticuerpo monoclonal contra el dominio extracelular de HER2, el producto de ERBB2, resultaba en la inhibición del crecimiento celular del cáncer de mama con sobreexpresión de este, fue así como las investigaciones se empezaron a dirigir hacia ese gen.23
Con el estudio de la HER2 y su implicación en el cáncer de mama, en 1992 la empresa Genentech, a la cual pertenecía Axel Ullrich, produjo el primer anticuerpo contra la HER2 nombrado herceptina (trastuzumab), del cual terminaron la fase clínica III en 1997. Mientras se desarrollaba la fase clínica II de la herceptina, en 1993 Douglas Easton y más tarde en 1995 Wooster, describieron la relación de dos genes con el desarrollo del cáncer de mama, BRCA1 y BRCA2, respectivamente.17
Fue hasta 1998 que se presentaron los resultados de las investigaciones clínicas de la Fase III de la herceptina a la Sociedad Americana de Oncología Clínica (ASCO, por sus siglas en inglés) y a finales de ese año la FDA aprobó su uso en mujeres con cáncer metastásico en tumores con sobreexpresión de HER2.
Años después AstraZeneca comenzó la búsqueda de un activo nuevo con alta afinidad al receptor de estrógeno y con actividad antagonista para evitar o disminuir los efectos adversos del tamoxifeno. Tras la experimentación con varias modificaciones, se obtuvo el compuesto ICI 182780, conocido como fulvestrant, el cual sería aprobado por la FDA en 2003 como una terapia endócrina de segunda línea para el tratamiento del cáncer metastásico con RE+.18 En el transcurso del tiempo se han desarrollado varios fármacos; sin embargo, en 2012 se publicaron los resultados del grupo de estudio CLEOPATRA (financiado por la corporación Genentech y la colaboración de Hoffmann-La Roche), estudio que se centró en evaluar la combinación de tres fármacos: pertuzumab, trastuzumab y docetaxel como terapia contra el cáncer de mama metastásico con HER2+.19 Es este estudio el que ha conseguido en la historia el mayor aumento de supervivencia en cáncer de mama avanzado, por lo que en 2012 la FDA aprobó la utilización del pertuzumab.

Con el paso del tiempo y el avance de la tecnología, se llegaron a identificar diversos genes diferencialmente expresados entre tumores mamarios, con lo que se llegó a la conclusión de que el cáncer de mama es altamente heterogéneo. En el año 2000, Charles M. Perou y Therese Sørlie, caracterizaron la variación de los patrones de expresión génica a través de microarreglos en 65 muestras de tumores mamarios. Los resultados los llevaron a proponer una clasificación de los tumores en cuatro subtipos moleculares.20 Tres años después, en 2003, Therese Sørlie a partir de la inmunohistoquímica, descubrió que los patrones de expresión génica de cada paciente se correlacionaban con la expresión de proteínas de superficie celular detectadas mediante esta técnica, por lo cual realizó una reestructuración en la clasificación molecular.21
En el 2006, Bruce G. Haffty denominó un subtipo molecular triple negativo para aquellos tumores mamarios que no expresaran receptores hormonales y fueran HER2-. Esta clasificación sigue vigente y es de suma importancia en la clínica, ya que es utilizada en la toma de decisiones sobre las estrategias de tratamiento que recibirá cada paciente de acuerdo con el subtipo molecular. Actualmente la investigación en genómica y la proteómica siguen demostrando avances. Tras la conclusión del proyecto del genoma humano en el año 2003, en el cual fueron identificados aproximadamente 25 000 genes, el Instituto de Cáncer de los Países Bajos en Ámsterdam creó la firma génica 70 (70GS), la cual involucra genes relacionados con el cáncer de mama. Fue así como desarrollaron el ensayo génico MammaPrint, en el cual se evaluaron los 70 genes para pronosticar la metástasis a distancia en pacientes de cualquier edad con ganglios linfáticos negativos.22
Actualmente en diversos países del mundo, los investigadores trabajan para encontrar mejores maneras de prevenir, detectar y tratar el cáncer de seno, y para mejorar la calidad de vida de pacientes y sobrevivientes de esta enfermedad.
Las industrias farmacéuticas impulsan día a día la investigación en nuevos targets para tratar más eficazmente el cáncer de seno. El conocimiento cada vez más profundo de la biología del tumor y de la respuesta inmune frente al mismo ha permitido identificar nuevas dianas terapéuticas y desarrollar medicamentos más precisos, más eficaces y con menores efectos secundarios. Adicionalmente, las nuevas técnicas diagnósticas. abordajes quirúrgicos innovadores, el impulso de programas de prevención y de detección precoz hacen que el cáncer de mama se convierta en uno de los tumores con mejor pronóstico cuando se aborda en fases tempranas. Si bien el cáncer de mama continúa con altos índices de prevalencia y mortalidad, el avance sobre su entendimiento ha aumentado en el último siglo. Tratamientos más precisos con aproximaciones terapéuticas persolizadas y nuevas técnicas moleculares e imagenológicas para el diagnóstico temprano son el foco de la investigación actual para prevenir y detectar de forma temprana la enfermedad, mejorar el pronóstico y aumentar la supervivencia de las y los afectados.
REFERENCIAS
- Lakhtakia R. (2014). A Brief History of Breast Cancer: Part I: Surgical domination reinvented. Sultan Qaboos University medical journal, 14(2), e166–e169.
- Donegan W. History of breast cancer. In: Winchester DJ, Hudis C, Norton L, ed. Breast cancer. Hamilton, Ontario: BC Decker; 2006:114.
- The History of Cancer | First Cancer Diagnosis. (s/f). Recuperado el 30 de septiembre de 2022, de https://www.cancer.org/treatment/understanding-your-diagnosis/history-of-cancer.html
- Mandell J. B. (2005). Bathsheba’s breast Women, cancer & history. Journal of Clinical Investigation, 115(6), 1397. https://doi.org/10.1172/JCI25456
- Olson JS. The History of Cancer: An Annotated Bibliography. New York: Greenwood Press; 1991:77.
- Lukong K. E. (2017). Understanding breast cancer – The long and winding road. BBA clinical, 7, 64–77. https://doi.org/10.1016/j.bbacli.2017.01.001
- ACKERKNECHT E. H. (1958). Historical notes on cancer. Medical history, 2(2), 114–119. https://doi.org/10.1017/s0025727300023528
- Halsted W. S. (1894). I. The Results of Operations for the Cure of Cancer of the Breast Performed at the Johns Hopkins Hospital from June, 1889, to January, 1894. Annals of surgery, 20(5), 497–555. https://doi.org/10.1097/00000658-189407000-00075
- Boyd S. (1897). On Oöphorectomy in the Treatment of Cancer. British medical journal, 2(1918), 890–896. https://doi.org/10.1136/bmj.2.1918.890
- Picard J. D. (1998). Histoire de la mammographie [History of mammography]. Bulletin de l’Academie nationale de medecine, 182(8), 1613–1620.
- Bergljung L. (2005). Sir Geoffrey Keynes 1887 – 1982. Kirurgisk pionjär, medicinhistoriker, humanist [Sir Geoffrey Keynes 1887-1982. Surgical pioneer, medical historian, humanist]. Svensk medicinhistorisk tidskrift, 9(1), 147–153.
- Jensen EV, Jacobson HI, Walf AA, Frye CA. Estrogen action: A historic perspective on the implications of considering alternative approaches. Physiol Behav. 2010;99:15162.
- Jordan VC. Tamoxifen: a most unlikely pioneering medicine. Nat. Rev. Drug Discov. 2003;2:20513.
- Das M, Miyakawa T, Fox CF, Pruss RM, Aharonov A, Herschman HR. Specific radiolabeling of a cell surface receptor for epidermal growth factor. Proc Natl Acad Sci. 1977;74:27904.
- Fisher B. The evolution of paradigms for the management of breast cancer: a personal perspective. Cancer Res. 1992;52:237183.
- Yamamoto T, Ikawa S, Akiyama T, Semba K, Nomura N, Miyajima N, et al. Similarity of protein encoded by the human c-erb-B-2 gene to epidermal growth factor receptor. Nature. 1986;319(6050):230-4
- Wooster R, Bignell G, Lancaster J, Swift S, Seal S, Mangion J, et al. Identification of the breast cancer susceptibility gene BRCA2. Nature. 1995;378(6559):789-92.
- Carlson R. W. (2005). The history and mechanism of action of fulvestrant. Clinical breast cancer, 6 Suppl 1, S5–S8. https://doi.org/10.3816/cbc.2005.s.008
- Baselga, J., Cortés, J., Kim, S. B., Im, S. A., Hegg, R., Im, Y. H., Roman, L., Pedrini, J. L., Pienkowski, T., Knott, A., Clark, E., Benyunes, M. C., Ross, G., Swain, S. M., & CLEOPATRA Study Group (2012). Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer. The New England journal of medicine, 366(2), 109–119. https://doi.org/10.1056/NEJMoa1113216
- Perou, C. M., Sørlie, T., Eisen, M. B., van de Rijn, M., Jeffrey, S. S., Rees, C. A., Pollack, J. R., Ross, D. T., Johnsen, H., Akslen, L. A., Fluge, O., Pergamenschikov, A., Williams, C., Zhu, S. X., Lønning, P. E., Børresen-Dale, A. L., Brown, P. O., & Botstein, D. (2000). Molecular portraits of human breast tumours. Nature, 406(6797), 747–752. https://doi.org/10.1038/35021093
- Sorlie, T., Tibshirani, R., Parker, J., Hastie, T., Marron, J. S., Nobel, A., Deng, S., Johnsen, H., Pesich, R., Geisler, S., Demeter, J., Perou, C. M., Lønning, P. E., Brown, P. O., Børresen-Dale, A. L., & Botstein, D. (2003). Repeated observation of breast tumor subtypes in independent gene expression data sets. Proceedings of the National Academy of Sciences of the United States of America, 100(14), 8418–8423. https://doi.org/10.1073/pnas.0932692100
- Van ‘t Veer, L. J., Dai, H., van de Vijver, M. J., He, Y. D., Hart, A. A., Mao, M., Peterse, H. L., van der Kooy, K., Marton, M. J., Witteveen, A. T., Schreiber, G. J., Kerkhoven, R. M., Roberts, C., Linsley, P. S., Bernards, R., & Friend, S. H. (2002). Gene expression profiling predicts clinical outcome of breast cancer. Nature, 415(6871), 530–536. https://doi.org/10.1038/415530a
- rrón-Gallardo, C. A., & Jave-Suarez, L. F. (s/f). Historia del cáncer de mama. Rev Med Inst Mex Seguro Soc., 8.